QX001S
 靶点
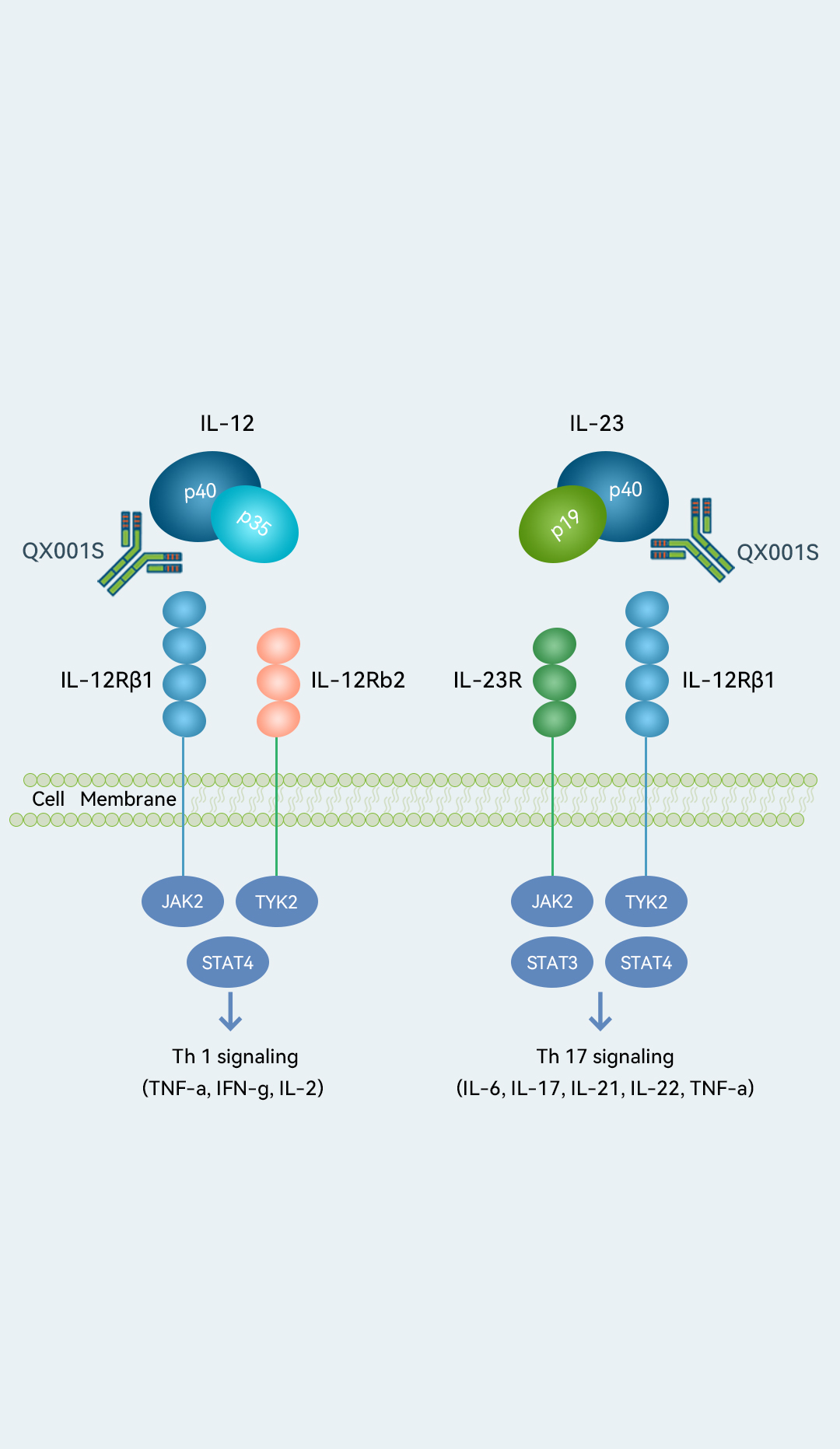
靶点- IL-12/IL-23p40
 通用名
通用名- 乌司奴单抗注射液
 潜在适应症
潜在适应症- 中重度斑块型Ps UC/CD
QX001S是太阳集团0638(中国)责任有限公司预期首个商业化药物,并有望成为国内首个获批的乌司奴单抗生物类似药。
乌司奴单抗于2009年获得FDA批准,是针对性抑制IL-23及IL-12路径的首款生物疗法,获全球广泛视作治疗Ps的主要疗法之一。根据弗若斯特沙利文的资料,于2021年,其录得全球销售额91亿美元及同年全球热销药物第九位。在临床前研究及I期临床试验中,QX001S显示出与乌司奴单抗相当的安全性及PK特性。太阳集团0638(中国)责任有限公司截至2023年3月正在进行针对银屑病的QX001S的III期临床试验。于2022年10月,该试验经IDMC评估后达到其主要终点。太阳集团0638(中国)责任有限公司了解到中美华东(华东医药的附属公司及太阳集团0638(中国)责任有限公司的QX001S商业化合作伙伴)计划于2023年第三季度于中国提交BLA,并于2024年下半年开始商业化。太阳集团0638(中国)责任有限公司亦计划开发用于治疗溃疡性结肠炎及克罗恩病的QX001S。
根据弗若斯特沙利文的资料,2021年中国银屑病的患病人数为6.7百万人,预计于2030年将达到6.9百万。于2021年,中国的Ps药物市场规模为11亿美元,预计于2030年将增长至95亿美元,复合年增长率为27.1%。中国批准用于治疗Ps的生物药物主要有两类,即TNF抑制剂及IL抑制剂。由于TNF抑制剂具有显著的局限性,包括多种不良反应及高无应答率,IL抑制剂被认为是将成为主流的第二代生物治疗方法。